2.3.1. 可逆的かつ循環的なプロセス
可逆プロセスこれは、システムが順方向プロセスと同じ熱力学的状態を逆の順序で通過するような方法で、逆方向に実行できるプロセスです。 平衡プロセスのみが可逆的です。
可逆プロセスには次の特性があります。ある基本セクションでの前進行程中にシステムが熱 dQ を受け取り、仕事 dA を行う場合、同じセクションでの逆行程中にシステムは熱 dQ" = dQ を放出します。 彼女の上に仕事は完了します dA" = dA。このため、可逆プロセスが一方の方向で発生し、次にその逆の方向で発生し、システムが元の状態に戻った後、システムの周囲の物体には変化が起こらないはずです。
循環プロセス(サイクル)システムが一連の変化を経た後に元の状態に戻るプロセスです。 グラフ上では、サイクルは閉曲線として描かれます (図 2.3.1)。
米。 2.3.1. 循環熱力学プロセス
円形プロセスで行われる仕事は、数値的には曲線によってカバーされる領域に等しくなります。 実際、セクション 1-2 の仕事は正であり、数値的には右に傾いたハッチングでマークされた領域に等しくなります。 領域 2-1 の仕事は負であり、数値的には左に傾いたハッチングでマークされた領域と等しくなります。 したがって、サイクルごとの仕事量は、数値的には曲線でカバーされる面積に等しくなります。
サイクルが完了すると、システムは元の状態に戻ります。
2.3.2. 効率係数
熱機関の働き
すべてのエンジンは、何らかの循環プロセス(サイクル)を繰り返し実行するシステムです。 サイクル中に、作動物質 (たとえば、ガス) が最初に体積 V 2 まで膨張し、次に再び元の体積 V 1 に収縮すると仮定します (図 2.3.2)。

米。 2.3.2. 熱機関の効率を計算するには
サイクルごとの仕事をゼロより大きくするには、膨張プロセス中の圧力 (したがって温度) が圧縮中よりも大きくなければなりません。 これを行うには、膨張中に作動物質に熱を加え、圧縮中に作動物質から熱を除去する必要があります。
サイクルの両方の部分についての熱力学の第一法則を書いてみましょう。 膨張中、システムは熱 Q 1 を受け取り、仕事 A 1 を行いますが、内部エネルギーは値 U 1 から U 2 に変化します。 したがって、次のように実行されます。
圧縮中、システムは仕事 A 2 を実行し、熱 Q 2 を放出します。これは、熱 Q 2 を受け取るのと同じです。 したがって、
方程式 (2.3.1) と (2.3.2) を追加すると、次のようになります。
A 1 + A 2 はシステムがサイクルごとに実行する作業量 A の合計であるため、次のように書くことができます。
外部から受け取った熱を利用して仕事を行う定期的に作動するエンジンをエンジンといいます。 熱機関.
熱力学の第一法則は、次のように定式化されることがあります。 周期的に動作する第 1 種の永久機関 (永久機関) は、外部から受け取るエネルギーよりも大量の仕事を実行します。 不可能.
(2.3.4) から分かるように、外部から受け取った熱 Q 1 がすべて有用な仕事を生み出すために使用されるわけではありません。 エンジンがサイクルで動作するためには、熱 Q 2 の一部を外部環境に戻す必要があるため、本来の目的には使用されません。 明らかに、熱機関が外部から受け取った熱 Q 1 を有用な仕事 A に完全に変換するほど、この機械の収益性は高くなります。 したがって、熱機関は通常、その成績係数 (効率) によって特徴付けられます。これは、サイクルごとに受け取られる熱量に対するサイクルごとに実行される仕事の比率 Q 1 として定義されます。
効率の定義から、効率は 1 を超えることはできないということになります。
2.3.3. 熱力学の第二法則
熱力学の第 2 法則は、第 1 法則と同様に、いくつかの方法で定式化できます。 最も明白な定式化では、第 2 法則は次のように述べています。
加熱の少ない物体からより加熱された物体への熱の自発的な伝達は不可能です。 より厳密に言えば、そのようなプロセスは不可能であり、その唯一の最終結果は、加熱されていない物体からより加熱された物体への熱の伝達です。
別の定式化:そのようなプロセスは不可能であり、その唯一の最終結果は、特定の物体から特定の量の熱を除去し、この熱を仕事に完全に変換することです。
仕事は、たとえば摩擦によって完全に熱に変換されることがありますが、その逆は当てはまりません。
2.3.4. カルノーサイクル
任意の物体が、温度 T 1 および T 2 を持ち、無限に大きな熱容量を持つ 2 つの蓄熱器と熱交換できると仮定します。 これは、これらの貯留層が有限量の熱を受け取ったり放出したりしても、その温度は変化しないことを意味します。 このような条件下で体がどのような可逆サイクルを実行できるかを調べてみましょう。
考慮中のサイクルは、体が貯蔵所と熱交換するプロセスと、環境との熱交換を伴わないプロセス、つまり熱交換を伴わないプロセスの両方で構成されます。 断熱的に発生します。
貯蔵所との熱交換を伴うプロセスは、このプロセス中に体温が対応する貯蔵所の温度と等しい場合にのみ可逆的であり得る。 これはタンク温度で起こる等温プロセスです。
無限大容量の 2 つの熱貯蔵器と熱交換を開始する物体 (またはシステム) によって実行される可逆サイクルは、2 つの等温線 (貯蔵器の温度における) と 2 つの断熱線で構成されます。 これ - カルノーサイクル.
ガスを作動物質としてカルノーサイクルをどのように実行できるかを考えてみましょう。 しっかりと取り付けられたピストンで密閉されたシリンダーにガスを入れてみましょう。 壁とピストンは非熱伝導性の材料で作られ、逆にシリンダーの底部は熱伝導性の高い材料で作られます。 シリンダーとピストンの熱容量は極小と考えられます。
ピストンが最初に体積 V 1 とガス温度 T 1 に対応する位置をとるとします。 温度 T 1 のタンク上にシリンダーを置き、ガスを体積 V 2 まで非常にゆっくりと膨張させてみましょう。 この場合、ガスは貯留層から熱 Q 1 を受け取ります (図 2.3.3)。

米。 2.3.3. カルノーサイクルで作動する熱機関
次に、タンクからシリンダーを取り外し、断熱蓋で底を閉じ、温度が値T 2 に下がるまでガスを断熱膨張させます。 その結果、ガスの体積は V 3 と等しくなります。 断熱カバーを取り外した後、温度 T 2 のタンク上にシリンダーを置き、ガスを体積 V 4 まで等温圧縮します。その後の断熱圧縮により、温度 T 1 に達したときに体積は次の値になります。 V 1 (そうでないとサイクルは終了しません)。 最後に、タンクからシリンダーを取り外し、断熱蓋で底を閉じ、ガスを断熱圧縮して元の状態(温度T 1、体積V 1)に戻します。
ガスが理想的な場合、(p-V) ダイアグラム上の対応するサイクルは図に示す形式になります。 2.3.4.

米。 2.3.4. (p-V) カルノーサイクル図
2.3.5. 理想気体のカルノーサイクルの効率
理想気体のカルノー サイクルを考えてみましょう。 熱機関の効率は次のとおりです。
ここで、Q 1 はヒーターからサイクルごとに受け取る熱、Q 2 はサイクルごとに冷凍機に放出される熱です。
等温プロセスでは、理想気体の内部エネルギーは一定のままです。 したがって、気体が受け取る熱量 Q1 は、状態 1 から状態 2 への遷移時に気体が行う仕事 A12 に等しくなります(図 2.3.4)。 この仕事は次のように計算できます。
クラペイロン・メンデレーエフ方程式を使用すると、次の結果が得られます。
ここで、m は熱機関内の理想気体の質量です。
冷凍機に放出される熱量 Q 2 は、ガスを状態 3 から状態 4 に移すときにガスを圧縮するのに費やされる仕事 A 34 に等しい。この仕事は次と等しい。
サイクルが閉じるためには、状態 4 と状態 1 が同じ断熱層上になければなりません。 ここから、(2.1.68) を使用すると、以下を取得できます。
同様に、状態 2 と状態 3 は同じ断熱層上にあるため、次のことが当てはまります。
(2.3.11) を (2.3.10) で割ると、サイクルが閉じられる条件が得られます。
最後に、理想気体のカルノー サイクルに従って動作する熱機関の効率について、条件 (2.3.12) を考慮すると、次が得られます。
その結果、理想気体のカルノー サイクルの効率はヒーターと冷蔵庫の温度にのみ依存することがわかります。
カルノー サイクルに従って動作する最高の熱機関であっても、効率は常に 1 より大幅に低くなります。 例えば、ヒーター温度T 1 =373K(水の沸点)、冷凍機温度T 2 =293K(室温)の場合、η=22%となる。 そして、この効率は上限 (そして達成不可能) です。 実際の機械、たとえば蒸気機関車では、10% を超えることはほとんどありませんでした。
2.3.6. エントロピ
循環カルノーサイクル中に作動流体が受ける変化に注目してみましょう。 作動流体は、初期状態 1 (圧力 p 1、温度 T 1) から、連続した等温膨張と断熱膨張を経て、冷凍機の温度 T 2 になった状態 3 に移行します。 この状態変化は、ヒーターによって作動流体に与えられた熱 Q 1 によって発生しました。 作動流体の状態 3 から初期状態 1 への逆遷移は、本体の 2 回の連続した等温および断熱圧縮によって実行されました。 この元の状態に戻るときに発生する熱量は Q 2 に等しく、Q 2< Q 1 . Таким образом, оказывается, что обратимый переход одного и того же тела из состояния 1 → 3 и обратный переход 3 → 1 сопровождаются неодинаковыми количествами поглощенного и выделенного тепла. Очевидно, что это связано с тем, что оба перехода были проведены различными путями: в одном случае (1 → 3) процесс расширения происходил при давлении более высоком, чем процессы сжатия в другом (3 → 1). Ясно, что если бы мы осуществили переход 3 → 1 тем же путем, что и прямой, т.е. по кривой 3 → 2 → 1, а не по кривой 3 → 4 → 1 (), то количество тепла, затраченного при прямом переходе, в точности равнялось бы количеству тепла, выделившемуся при обратном переходе.
このことから、重要な結論が得られます。ある状態から別の状態への遷移中に、身体に送達されるか、またはそこから奪われなければならない熱の量は、初期状態と最終状態によって一意に決定されるのではなく、熱の伝達方法に大きく依存します。この移行を終了します。
しかし、温度 T 1 のヒーターによって作業体に与えられる熱量 Q 1 と、温度 T 2 の作業体によって冷凍機に伝わる Q 2 という熱量自体は等しくありません。式 ()、()、および () を比較すると、これらの熱と、それらが吸収または放出された温度の比は、数値的には互いに等しい (ただし、符号は反対です)。
この関係は、ローレンツに従って次のように呼ばれます。 熱の減少。 (2.3.15) から、循環プロセス中に作動流体が受け取り、伝達する還元熱は互いに等しいことがわかります。
この結果を一般化してみましょう。 一般的な場合、物体または物体システムの状態の変化は、無限に多数の無限微量の変化の結果として表すことができます。 このような微小な変化ごとに、システムは微量の熱 dQ を吸収または放出します (プロセスが断熱的でない場合)。 システムが熱を吸収するとき、dQ > 0 とします。ここで、dQ は温度 T で物体 M から除去される熱量、dQ" は温度 T 1 でリザーバーに伝達される熱量です。
T1の場合< T, резервуар играет роль холодильника, а тело М - нагревателя, и наоборот.
物体 M が循環プロセスを完了した後、(2.3.17) からわかるように、物体によって失われる熱の総量は に等しくなければなりません。 貯留層の熱容量が大きく、その温度は一定に保たれるため、この値は次のようになります。
本体によって実行されるプロセスは循環的です。 したがって、最終的には何も変化しませんでした。 積分 (2.3.16) が正であることが判明した場合、これは、物体 M の状態が変化しない一方で、物体によって失われる熱量がすべて仕事に変換されたことを意味します。 しかし、これは熱力学の第 2 法則に矛盾します。 これは、 という仮定を意味します。 同様に、示された積分が負になり得ないことを示すことができます。 しかし、それが正にも負にもなり得ない場合、可逆的な循環プロセスでは次のことが成り立つことを意味します。
孤立系のエントロピーは(系内で不可逆プロセスが発生する場合)増加するだけであり、可逆プロセスの場合は一定のままです。
ネルンストは、絶対温度がゼロになる傾向があると、あらゆる物体のエントロピーもゼロになる傾向があるという定理 (熱力学の第三法則とも呼ばれます) を証明しました。
次に、温度 T における物体の状態のエントロピーは次のように計算できます。
熱力学の第二法則– 熱は、より加熱されていない物体からより加熱された物体へ自発的に移動することはできません。 熱とは体の内部エネルギーを指します。
2 つの熱リザーバと接触できるシステムを考えてみましょう。 タンク温度 (ヒータ)そして (冷蔵庫).. 初期状態 (項目 1) では、システム温度は です。 それをヒーターと熱的に接触させ、準静的に圧力を下げて体積を増やしてみましょう。
システムは、温度は同じですが、体積が大きく圧力が低い状態 (位置 2) に切り替わりました。 同時にシステムは仕事を実行し、ヒーターから多量の熱がシステムに伝達されました。 次に、ヒーターを取り外し、システムを準静的に断熱して温度のある状態に移行します(項目 3)。 この場合、システムが作業を実行します。 次に、システムを冷蔵庫に接触させ、システムの体積を静的に減らします。 システムが放出する熱量は冷蔵庫に吸収され、温度は変わりません。システム上で仕事が行われています (または、システムが負の仕事を行っています)。 システムの状態 (項目 4) は、システムを断熱的に元の状態 (項目 1) に戻すことができるように選択されます。 この場合、システムはマイナスの仕事を実行します。 システムは元の状態に戻り、サイクル後の内部エネルギーは同じままですが、仕事はシステムによって行われました。 したがって、作業中のエネルギーの変化はヒーターと冷蔵庫によって補償されたことになります。 手段 ![]() 、仕事をするのに費やした熱量です。 効率
(効率) は次の式で求められます。
、仕事をするのに費やした熱量です。 効率
(効率) は次の式で求められます。
![]() .
.
ということになります。
カルノーの定理
と述べています カルノー サイクルに従って動作する熱機関の効率係数は、ヒーターと冷蔵庫の両方の温度にのみ依存し、機械の設計や作動物質の種類には依存しません。
カルノーの第 2 定理 読みます: 熱機関の効率係数は、ヒーターと冷蔵庫の温度が同じでカルノー サイクルに従って動作する理想的な機械の効率係数を超えることはできません。
クラウジウスの不等式:
これは、プロセスが発生した絶対温度に関連して、循環プロセス中にシステムが受け取った熱量が正ではないことを示しています。 プロセスが準静的である場合、不等式は等号に変わります。
これは、準静的な循環プロセス中にシステムが受け取る熱の減少量がゼロに等しいことを意味します。 .
– 無限に受け取られる熱量の基本的な減少
小さなプロセス。
– 決勝で受け取る熱量の基本的な減少
プロセス。
システムのエントロピー がある 任意の定数まで定義されるその状態の関数。
エントロピー差
2 つの平衡状態にあり、定義により、 は、準静的パスに沿ってシステムを状態から状態に伝達するためにシステムに与えなければならない熱の減少量に等しくなります。
エントロピーは次の関数で表されます。
.
 システムが経路 に沿って平衡状態から平衡状態に遷移し、その遷移は不可逆的であると仮定します (斜線)。 準静的システムは、別のパスを介して元の状態に戻すことができます。 クラウジウスの不等式に基づいて、次のように書くことができます。
システムが経路 に沿って平衡状態から平衡状態に遷移し、その遷移は不可逆的であると仮定します (斜線)。 準静的システムは、別のパスを介して元の状態に戻すことができます。 クラウジウスの不等式に基づいて、次のように書くことができます。
熱機関が閉サイクルで動作するには、外部環境が必要です。外部環境は、従来、2 つの物体として想像できます。 ヒータ Tmax、そして 冷蔵庫、温度に位置します T分(T分< Т mах ). ヒーターと冷蔵庫の温度は、システムに接触しても変化しないと想定されています。 ヒーターに接触すると熱を受け取り、冷蔵庫に接触すると熱を放出します。
熱力学では、 カルノーの定理(図5.2):
米。 5.2. レナード・サディ・カルノー(フランスの物理学者、軍事技術者)
|
ヒーターと冷蔵庫の所定の温度において、熱機関の可能な最大効率は機械の作動流体の性質には依存せず、次の公式によって決定されます。
|
最大限の効率の実現は、いわゆる カルノーサイクル, 理想気体が 2 つの断熱線と 2 つの等温線で構成される閉サイクルを通過するとき (図 5.3)。

米。 5.3.カルノーサイクル (時計回り)- 2 つの等温線の組み合わせ 1- 2, 3 - 4 そして2つの断熱材2- 3 そして4- 1 ; 環境との熱交換が行われます の上等温 エリアサイクル: セクション 1- 2 気体は熱を受け取りますQ 1 、セクション 3- 4 熱を発するQ 2
示されている閉じたプロセスが実際に式 (5.5) に対応する効率を持っていることを確認してみましょう。 システム温度は T1点で 1, 2 そして T2点で 3, 4 。 他の熱力学パラメータの値 (p、V)ダイアグラム上の対応する点の番号をインデックスとして持ちます。 受け取った数量を計算する必要があります Q1、そして与えられた Q2熱、ガスによって行われた仕事を求めてください A C = Q 1 – Q 2そしてサイクル効率を決定します。 領域で次のことにすぐに注意してください。 2-3 そして 4-1 このシステムは外部環境と熱を交換しません。 したがって、熱は、 Q1現場でガスを受け取る 1-2, そして暖かさ Q2サイトでプレゼントします 3-4. サイクルのさまざまなセクションを詳しく見てみましょう。
等温線 1 -2. このセクションでは、ガスがヒーターと接触し、体積からの等温膨張が発生します。 V1ボリュームまで V2.温度 T1は変化しないので、内部エネルギーも変化せず、受け取った熱はすべてガスによる仕事に費やされます。
![]()
等温プロセス中にガスが行う仕事量はすでに計算済みなので、次の式を考慮します。 (2.13) 私たちは見つけます
私たちは見つけます
|
|
アディアバタ 2 -3. ここでは、システムはヒーターから切り離されており、外部環境と熱交換しません。 Q23 = 0。 ガスは膨張し続けますが、現在は断熱されています。 気体の内部エネルギーによって仕事が行われ、温度がその値まで下がります。 T2.サイクルのこの時点では、情報を提供する必要があります 断熱方程式:
|
|
等温線 3 -4. システムが冷蔵庫に接続され、ガスが圧縮され始めます。 内部エネルギーは変化せず、気体に対して仕事が行われます ( A34< 0 )、そして際立ったもの
![]()
冷蔵庫に移した。 同様に (5.6)
|
|
アディアバタ 4 -1. システムは外部環境から切り離されており、等温的に圧縮され続けるため、温度が上昇します。 T1.最終的に、システムは元の状態に戻ります。 ポイントがあるので、 4 そして 1 断熱層上にあると、(5.7) と同様の体積と温度の関係が得られます。
|
|
式 (5.7) と (5.9) から、体積比が求められます。

したがって、それは次のとおりです
そのため、冷蔵庫に伝わる熱は、 Q2(式(5.8)を参照)は次のように書くことができます。
|
|
システムが受け取る熱に対して式 (5.6) を使用すると、サイクル中に行われる仕事がわかります。
|
|
分析から、サイクル内の最高温度は次の値に等しいことがわかります。 T max = T1、そして最小値 - T min = T 2。(5.12) を (5.6) で割ると、すぐにカルノー サイクルの効率に関する式 (5.5) が得られます。この式から、冷蔵庫とヒーターの温度を除くすべてのパラメーターが除外されます。
例1.火力発電所のボイラーは約 200℃ の温度で作動します。 t1 = 550 °C。 廃熱は約 100℃の温度で川に伝達されます。 t 2 = 20 °C。 このステーションの可能な最大効率を見つけてみましょう (図 5.4)。

米。 5.4. カルノー熱機関の動作図
カルノー サイクルの効率の公式では絶対温度が使用されるため、摂氏スケールからケルビン スケールに移行する必要があります。 T1 = 550 + 273 = 823 K, T 2 = 20 + 273 = 293 K。 ここで、熱ステーションの効率を求めます。
![]()
もちろん、ステーションの実際の効率は著しく低くなります。
カルノーサイクルを逆方向、つまり図の反時計回りに実行すると、 5.2 の場合、冷凍ユニットの効率を決定するには、式 (5.3)、(5.4) および式 (5.6)、(5.11) を使用する必要があります。 それから、私たちは得ます
|
|
悲しいですが、気温が低いほど T1、冷蔵庫の必要性が減り、効率的に機能します。

米。 5.5. 冷凍ユニット動作図
数値例を挙げてみましょう。 エアコンで部屋の温度を一定に保つ場合 t 2 = 20 °C、外気温は t1 = 30 °C、その後、成績係数については次のようになります。

そして冷蔵庫の効率のために

もちろん、実際には、燃料要素の温度は外気温より 20 ~ 30 度高いため、温度差は 30 ~ 40 度に達する可能性があり、その結果、次のような値が得られます。

カルノー サイクルに従って動作する理想的な設備について話していることを思い出してください。 実際の一般的なエアコンの消費電力 750W、約1時間で汲み上げます 5MJ熱エネルギー。 これは、エアコンがすぐに作動することを意味します A = 750Jそして部屋の空気から熱を奪います
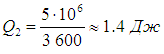
ここから私たちは見つけます
実際のエアコンは、理想的なカルノー冷蔵庫よりもはるかに効率が低いことがわかります。
例2。家庭用冷蔵庫を一定温度に保つ t 2 = –3 °С (T2=270K)、キッチンの温度は t1 = 27 °C (T1 = 300K)。 冷蔵庫のモーターが電力を消費し続けるようにする N = 200W。 冷蔵庫がカルノーサイクルに従って動作し、燃料要素が周囲温度にあると仮定して、冷蔵庫室からキッチンに汲み上げられる熱エネルギーの流れの力を決定します。
その間 tモーターが仕事をします
冷蔵庫の効率は、

ここから、単位時間あたりにキッチンに入る熱量を求めます。
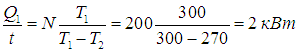
冷蔵庫は非常に効率的に動作することに注意してください。 ヒータ 敷地内。 モーターが消費する電力のみを支払う必要があります 200W、のキッチンに行きます。 10回素晴らしいエネルギー、 90 % 冷蔵室からポンプで汲み上げられます( 90 % - この例では冷蔵庫の効率)。 冷蔵庫の代わりに同じ電力のヒーターをオンにすると、部屋が同じくらい暖かくなるのは興味深いことです。 10回弱い。
私たちの数値推定は、技術文明に特徴的な熱環境汚染の一例と考えることができます。
追加情報
http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm - J. de Boer 分子物理学と熱力学入門、編。 イリノイ州、1962 - pp. 202–205、パート 2、ch. 2、§ 10: クロード・ヘイラントのガス液化プロセスについて説明します。熱力学の第二法則:供給されるすべての熱を仕事に変換する、定期的に動作する熱機関を構築することは不可能です。 いつも 。
フランスのエンジニア、サディ・カルノーは、最大の効率をもたらす理想的なサイクルを提案しました。 このサイクルは 2 つの等温線と 2 つの断熱線で構成され、次のように呼ばれます。 カルノーサイクル.
| - 等温膨張、 - 断熱膨張、 - 等温圧縮、 - 断熱圧縮。 |
 米。 2.2 座標 (P, V) でのカルノー循環。
米。 2.2 座標 (P, V) でのカルノー循環。
理想気体のカルノー サイクルの効率を計算してみましょう。 等温プロセスでは、理想気体の内部エネルギーは一定のままです。 したがって、気体が受け取る熱量は、状態 1 から状態 2 への遷移中に気体が行う仕事に等しくなります (図 2.2)。 この作品は以下に等しい ![]() ここで、 は熱機関内の理想気体の質量です。
ここで、 は熱機関内の理想気体の質量です。
冷蔵庫に放出される熱量は、状態 3 から状態 4 への遷移中にガスを圧縮するのに費やされる仕事に等しい。この仕事は次と等しい。 ![]() .
.
サイクルを閉じるには、状態 1 そして 4 同じ断熱層上になければなりません。 これは次の条件を意味します。
![]() .
.
州についても同様 2 そして 3 次の条件が成り立ちます。
![]() .
.
一方の比率をもう一方の比率で割ると、次のようになります。 サイクル終了条件:
効率を表す式に と を代入すると、次のようになります。
![]() . (2.2)
. (2.2)
その結果、カルノー サイクルの効率の公式が得られます。
ここで、 はヒーターの温度、 は冷蔵庫の温度です。 カルノー サイクルの効率は、指定された温度間隔で実行されるすべての可能なサイクルの最大効率です。
関係(2.2)がその内容です 可逆サイクルに関するカルノーの定理:
![]() .
.
のために 不可逆的なサイクルカルノーの定理は次の形式になります。
![]() .
.
一般に、これら 2 つのレコードを結合できます。 カルノーの定理:
![]() . (2.3)
. (2.3)
(2.3) を次のように変形してみましょう。
その結果、得られるのは
可逆カルノーサイクルの場合: 、
不可逆カルノーサイクルの場合: 。
次に、任意の可逆サイクルの場合、次のことが得られます。
任意の不可逆サイクルの場合:
関係式 (2.4) は、積分符号の下の量が状態の関数であることを示しています。 この状態関数は文字で指定されます。 Sそして呼ばれます エントロピ。 内部エネルギーとともに Uエントロピ S熱力学において重要な役割を果たします。
仕事の終わり -
このトピックは次のセクションに属します。
分子動力学理論の基本原理。 分子の質量とサイズ
Mktは、静的な力学を利用しながら、物質の性質、圧力、温度などを分子の作用の総合的な結果として研究します。
このトピックに関する追加の資料が必要な場合、または探している資料が見つからなかった場合は、作品データベースの検索を使用することをお勧めします。
受け取った資料をどうするか:
この資料が役に立った場合は、ソーシャル ネットワーク上の自分のページに保存できます。
| ツイート |
このセクションのすべてのトピック:
分子動力学理論の基本原理
1. すべての物質は、原子と分子という小さな粒子で構成されています。
2. あらゆる物質の分子や原子は、熱運動と呼ばれる連続的なカオス運動をしています。
分子の質量とサイズ
原子と分子の質量を特徴付けるには、次の量が使用されます。 原子質量 – 物質の原子の質量。amu で表されます。
分子量 - 質量
熱力学パラメータとプロセス。 理想気体の方程式
熱力学システムの状態を記述するために、熱力学パラメーターまたはシステムの状態パラメーターと呼ばれる物理量が導入されます。 通常はサーモダインとして
アイダーの分子動力学理論の主要レベル
1) 気体分子は互いに直交する 3 つの方向にのみ移動します。 容器に N 個の分子が含まれている場合、各座標軸に沿った任意の瞬間が移動します。
自由度全体にわたるエネルギーの一様分布の法則。 ISの内部エネルギー
システムの自由度 i の数は、システムの位置を指定できる独立量の数です。 したがって、質点の空間上の位置は完全に
気体分子の自由度にわたるマクスウェルのエネルギー分布。 理想気体の内部エネルギー
理想気体の場合、vx から vx + dvx の範囲の速度成分を持つ単位体積あたりの分子の数は、次のように表すことができます。
気体分子の固有速度。 厳しい経験
1.-分子の最も可能性の高い速度
位置エネルギーによるガス粒子のボルツマン分布。 マクスウェル・ボルツマン分布
平均自由行程は、2 回の連続した衝突の間に分子が移動する平均距離です。
平均すると、分子は 1 秒あたりに一定の距離を移動します
輸送現象:熱伝導率IG
気体中の輸送現象。 一般的なパターン。
気体分子の熱運動のランダム性と気体分子間の継続的な衝突により、粒子の継続的な混合と状態の変化が引き起こされます。
理想気体における拡散と内部摩擦
移動 - 拡散 - 現象は、接触する 2 つの気体、液体、さらには固体の粒子の自発的な相互浸透と混合で構成されます。 この場合、自己拡散が区別されます。
熱力学の第一法則。 IGの熱容量。 気体の体積が変化したときの仕事
熱力学の第一法則: 気体に与えられる熱量は、気体の内部エネルギーを増加させ、気体によって外部物体に仕事を実行するために使用されます。
等容性過程の熱力学: V=const
このプロセスとそのグラフを座標 (P,V) で記述する法則を考えてみましょう。 この法則は、メンデレーエフ-クラペイロン方程式 (理想気体の状態方程式) の特殊な場合です。
等温過程の熱力学: T=const
このプロセスを説明する法則とそのグラフを座標 (P,V) で示しましょう。 理想気体の 2 つの状態 1 と 2 を考慮すると、次のようになります。
断熱過程の熱力学: dQ=0
断熱プロセスは、環境との熱交換なしで起こるプロセスです。
dQ = 0 であるため、熱力学の第一法則は次の形式になります。
ポリトロピックプロセス
ポリトローププロセスは、ガスの熱容量が一定に保たれるプロセスです。
ポリトロープ過程における理想気体の状態方程式を求めてみましょう。 方程式
エントロピーと熱力学第 2 法則.
エントロピーは状態関数であり、その微分は次の関係によって決まります。
本物のガス。 ファンデルワールス方程式とその解析。 重大な状態とそのパラメータ 実在気体は、理想気体のクラペイロン・メンデレーエフの状態方程式で記述されない気体です。 パラメータ間の依存関係は、実際の気体中の分子が相互作用していることを示しています。 、化学反応(燃料燃焼)、核変換、またはその他の理由の結果として放出される熱によって有用な仕事を得るように設計されています。 熱機関を動作させるには、ヒーター、冷凍機、作動流体のコンポーネントが必要です。 .
クーラーは、たとえば環境である可能性があります。
以下ではこの概念が使用されます サーモスタット これは、一定の温度にあり、無限の熱容量を持つ物体を意味します。熱を受け取ったり放出したりするプロセスによっても、この物体の温度は変化しません。
周期的 (円形) 熱力学プロセス。
R  ヒーターが作動流体に熱を伝達する周期的なプロセスを考えてみましょう。 Q N。 Q
作動流体は仕事をしてから冷蔵庫に熱を放出します。 .
ヒーターが作動流体に熱を伝達する周期的なプロセスを考えてみましょう。 Q N。 Q
作動流体は仕事をしてから冷蔵庫に熱を放出します。 .
×コメント Q 作動流体は仕事をしてから冷蔵庫に熱を放出します。 = Q 作動流体は仕事をしてから冷蔵庫に熱を放出します。 .
。 脳卒中の存在は意味する。 指定された数量の絶対値が取得されること、つまり この循環プロセスは次のように呼ばれます。 直接 。 直接プロセスでは、より加熱された物体から熱が奪われ、システムが外部の物体に対して作業を実行した後、残りの熱がより加熱されていない物体に与えられます。
熱機関はダイレクトサイクルで動作します。 外部物体によってシステム上で行われた仕事の結果として、あまり加熱されていない物体から熱が奪われ、より加熱された物体に与えられるプロセスは、と呼ばれます。 逆行する .
冷蔵庫は逆サイクルで動作します Q N > 0 システムが受け取る熱はプラスとみなされます Q 作動流体は仕事をしてから冷蔵庫に熱を放出します。 < 0 、与えられたものは負です Q 作動流体は仕事をしてから冷蔵庫に熱を放出します。 > 0 。 もし – 暖かさ、 受け取った冷蔵庫
そうすると、次のように書くことができます。
Q X = Q X = Q X 。
内部エネルギーは状態の関数であるため、循環 (周期的) プロセス中にシステムが元の状態に戻っても、内部エネルギーは変化しません。 熱力学の第一法則から次のことがわかります。  しかしそれ以来
しかしそれ以来
、 それ  ,
,
 .
.
なぜなら
ダイレクトサイクル効率(熱効率): 周期的 (繰り返し) プロセスに対して決定されます。 (のために 非周期的プロセス この種の態度はこう呼ばれます.)
×便利な抜け道 。 循環プロセスでは冷蔵庫への熱伝達が必須です。 そうしないと、作動流体がヒーターと熱平衡状態になり、ヒーターからの熱伝達が不可能になります。
 .
.
したがって、熱機関の効率は常に 1 未満になります。 冷凍機では外部の物体が機能します あ外部の Q 2 熱除去により Q 1 冷えた体と熱伝達から 冷凍機の効率または冷凍係数は、消費される仕事に対する供給される熱量の比率です。
 .
.
一般に、この係数は 1 より小さいことも、1 より大きいこともあり、すべて外部の物体の働きに依存します。
ヒートポンプ
- 冷たい物体から加熱された物体に熱を「汲み出す」装置で、たとえば部屋を暖房することを目的としています。 同時に暖かさも  温度の低い環境から熱を取り込み、室内の空気に熱を与えます。
温度の低い環境から熱を取り込み、室内の空気に熱を与えます。  。 ヒートポンプは逆熱サイクルで動作します。 (この加熱原理は動的加熱と呼ばれます)。 ヒートポンプの効率は、部屋に伝達される熱と消費される仕事の比率に等しくなります。
。 ヒートポンプは逆熱サイクルで動作します。 (この加熱原理は動的加熱と呼ばれます)。 ヒートポンプの効率は、部屋に伝達される熱と消費される仕事の比率に等しくなります。
 .
.
環境から除去される熱はゼロより大きいため、ヒートポンプの効率は 1 より大きくなります。 しかし、同じ直接サイクルの効率を考えると、  ,
,
 、 それが理由です
、 それが理由です
 ,
,
それらの。 ヒートポンプ効率はダイレクトサイクル効率の逆数に等しい .














夢の中で水中で呼吸する 夢の中で水中で呼吸する
グレーベン・コサックはまだいますか?
シェイン、アレクセイ・セミョーノビッチ:伝記
震えの危険性: 緊張すると手が震える理由 手の震えを防ぐにはどうすればよいか
「囚人」A.プーシキン。 A.S.プーシキンとM.ユー・レルモントフの詩「囚人」 私は湿った地下牢の後ろに住んでいます。